ПРЯМЕ ПОСИЛАННЯ НА ТЕСТ
Домашнє завдання для 11 класу. Термін виконання до 07.11.2018.
Завдання необмежені за часом. Включають тести з ізомерії насичених вуглеводнів (номенклатура) та задачі з находження формули речовини за відсотковим складом.
кр11 from Владимир Малеваный
28.04.2017 розміщено завдання з теми "Електролітична досоціація. реакції йонного обміну."
Термін виконання до 03.05.2017 18:00
Йонні реакції
При взаємодії електролітів сполучається тільки протилежно заряджені йони. Якщо при цьому утвориться нова речовина у вигляді осаду, газу, слабкого електроліту, то такі реакції можна вважати необоротними, тобто як такі, що йдуть до кінця. Такі реакції називаються йонними і записують їх йонними рівняннями.
При складанні реакцій йонного обміну слід пам’ятати:
Щоб зробити висновок про перебіг реакцій йонного обміну до кінця треба використати дані таблиці розчинності солей, основ і кислот у воді. Розглянемо реакцію утворення нерозчинної сполуки аргентум хлориду із натрій хлориду і аргентум нітрату.
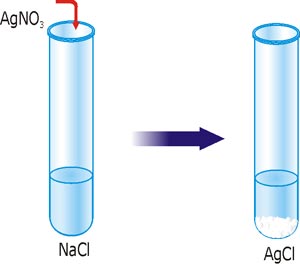
Рис. 26. Реакція йонного обміну з утворенням осаду AgCl.
Складаємо молекулярне рівняння реакції:
NaCl + AgNO3 = AgCl↓ + NaNO3.
NaCl + AgNO3 = AgCl↓ + NaNO3.
За таблицею розчинності бачимо, що сполуки NaCl, AgNO3 і NaNO3 розчинні, тому у водному розчині вони знаходяться у вигляді йонів. AgCl – нерозчинна, формула цієї речовини залишаються у молекулярному вигляді, за нею вказуємо стрілочку вниз.
Записуємо повне йонне рівняння:
Na+ + Cl– + Ag+ +
NO3– = AgCl↓ +
Na+ +
NO3–.
Відмічаємо йони, які в процесі реакції не зазнали змін і вилучимо їх з правої та лівої частини рівняння (скорочуємо). Утворення осаду зводиться до взаємодії йонів Ag+ і Cl–, так як утворилася нерозчинна сполука AgCl. Всі інші йони участі в реакції не прийняли. Записуємо скорочене йонне рівняння: Ag+ + Cl– = AgCl↓.
Скорочене йонне рівняння показує між якими йонами практично відбулася реакція, що призвела до зв’язування йонів. В цій реакції вам були відомі вихідні речовини для отримання вказаної сполуки. Але на практиці часто доводиться самому підбирати вихідні речовини.
Наприклад, якими речовинами ви можете скористатися, щоб добути нерозчинну сполуку BaSO4. Для утворення BaSO4 прийняли участь йони Ba2+ + SO42– = BaSO4. Зрозуміло, що вихідні речовини мають бути розчинні. Знаходимо в таблиці розчинності розчинні сполуки барію. Це можуть бути: Ba(OH)2, Ba(NO3)2, BaCl2, BaI2. Тепер знаходимо в таблиці розчинності розчинні сполуки з аніоном SO42–. Це можуть бути: H2SO4, Li2SO4, K2SO4, MgSO4, ZnSO4 та інші. Підбираємо дві довільні речовини з цих груп, наприклад BaCl2 і Na2SO4.
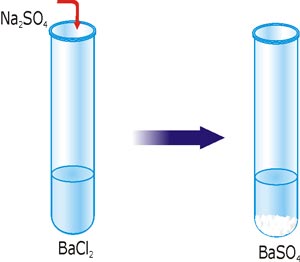
Рис. 28. Реакція йонного обміну з утворенням осаду BaSO4.
Йонні реакції-реакції між йонами.
Складаємо молекулярне рівняння реакції:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl.
Записуємо повне йонне рівняння: Ba2+ +
2Cl– +
2Na+ + SO42– = BaSO4 +
2Na+ +
2Cl–.
Вилучивши з правої та лівої частини рівняння ті йони, які не змінили свого складу впродовж реакції, запишемо йони, які практично провзаємодіяли між собою: Ba2++ SO42– = BaSO4 (скорочене йонне рівняння).
Цю нерозчинну сполуку можна отримати іншим способом. Аніон SO42– входить до складу сульфатної кислоти. Кислоти взаємодіють з оксидами металічних елементів, гідроксидами і солями з утворенням солі. Для прикладу використаємо барій оксид.
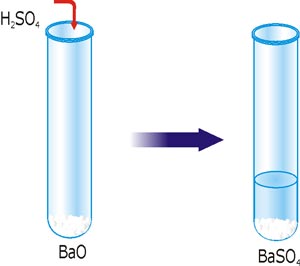
Рис. 28. Реакція йонного обміну з утворенням осаду BaSO4.
Записуємо молекулярне рівняння реакції, і підкреслюємо нерозчинні або малодисоційовані сполуки: BaO + H2SO4 = BaSO4↓ + H2O.
Повне йонне рівняння матиме вигляд: BaO + 2H+ + SO42– = BaSO4 + H2O.
В даному випадку відбулося зв’язування йонів H+ і SO42– з оксидом барію, з утворенням нерозчинного BaSO4 і малодисоційованої сполуки H2O.
Якщо при взаємодії двох сильних електролітів утворюються два сильні електроліти, то такі реакції являються оборотними, наприклад: K2SO4 (розчинна) + CuCI2 (розчинна) ⇄ 2KCI (розчинна) + CuSO4 (розчинна):
2K+ + SO42– + Cu2+ + 2Cl– ⇄ 2K+ + 2Cl– + Cu2+ + SO42–.
Оскільки не відбувається зв’язування йонів, то практично реакція не відбувається.
Складаючи рівняння реакцій йонного обміну, під час яких утворюються газоподібні речовини, слід врахувати, що аніони CO32–, SO32–, S2– здатні реагувати з кислотами, з утворенням відповідного газу:
SO32– + 2H+ → H2O + SO2↑;
S2– + 2H+ → H2S↑;
CO32– + 2H+ → H2O + CO2↑.
SO32– + 2H+ → H2O + SO2↑;
S2– + 2H+ → H2S↑;
CO32– + 2H+ → H2O + CO2↑.
Лабораторний дослід 2. Реакції, в результаті яких утворюється осад
В одну пробірку влийте 3–4 мл розчину купруму (II) сульфату, в другу – ферум (III) хлориду, в третю – барій хлориду. У перші дві пробірки добавте трохи розчину натрій гідроксиду, а в третю – сульфатної кислоти.
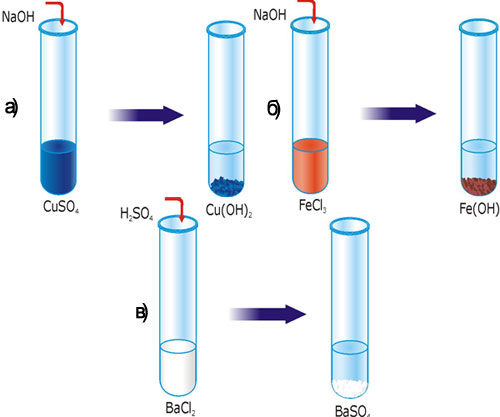
Рис. 29. Реакція йонного обміну з утворенням осаду: а) Cu(OH)2 ; б) Fe(OH)3; в) BaSO4.
Завдання: Складіть рівняння реакцій в молекулярному, повному і скороченому йонному вигляді. Поясніть, чому утворилися осади? Які речовини випали в осад? Розчини яких ще речовин можна влити в пробірки, щоб випав осад?
Лабораторний дослід 3. Реакції, в результаті яких виділяється газ
В пробірку влийте 2-3 мл розчину натрій карбонату і добавте кілька крапель хлоридної кислоти.
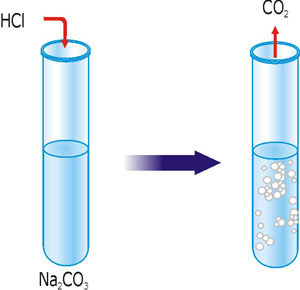
Рис. 30. Реакція йонного обміну з утворенням газу.
Завдання: Складіть рівняння реакції, що відбулася в молекулярному, повному і скороченому йонному вигляді. При дії яких кислот на цей розчин можна отримати аналогічні результати?
Лабораторний дослід 4. Реакції, в результаті яких утворюються малодисоційовані речовини
В одну пробірку влийте 2-3 мл розчину натрій гідроксиду і добавте 1-2 краплі фенолфталеїну. Розчин набуде малинового забарвлення. Потім влийте розчин хлоридної або сульфатної кислоти до знебарвлення.
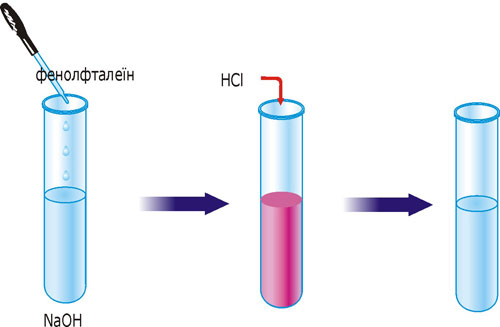
Рис. 31. Реакція йонного обміну з утворенням малодисоційованої сполуки води.
Основні положення теорії окисно-відновних реакцій.
1. Окисненням називають процес віддачі електронів атомом, молекулою або йоном. Атоми, молекули або йони, що віддають електрони, називають відновниками.
Елемент відновник втрачає електрони.
Наприклад: відновник Zn0 – 2ē → Zn+2, процес окиснення.
S+4 – 2ē → S+6
S–2 – 8ē → S+6
S–2 – 2ē → S0
Втрата атомом електронів (ē) веде до збільшення позитивного і зменшення негативного заряду.
2. Відновленням називають приєднання електронів атомом, молекулою або йоном. Атоми, молекули або йони, що приєднують електрони, називають окисниками.
Наприклад: окисник S0 + 2ē → S–2, процес відновлення.
Елемент окисник отримує електрони.
Cu+2 + 2ē → Cu0
S+6 + 8ē → S–2
N+5 + 3ē → N+2
S+6 + 8ē → S–2
N+5 + 3ē → N+2
Приєднання атомом електронів веде до збільшення негативного і зменшення позитивного заряду.
3. Число електронів, що їх віддає відновник, дорівнює числу електронів, які приєднує окисник.
4. Окиснення завжди супроводжується відновленням, і, навпаки, відновлення завжди пов’язане з окисненням.
Немає коментарів:
Дописати коментар